
-
Rozwój produktu leczniczego
-
Badania kliniczne
-
Jakość
-
Audyty GxP
-
Usługi Rejestracyjne
-
Wsparcie przedrejestracyjne
- Regulatory roadmap
- Usługa Scientific Advice
-
Druki informacyjne
-
Dokumentacja rejestracyjna
- Audyt dossier
- Proces rejestracji
- Obsługa porejestracyjna
- Regulatory outsourcing
-
Wsparcie przedrejestracyjne
-
Pharmacovigilance
-
Usługa QP / Import
Przygotowanie Wniosku Rejestracyjnego
Jednym z kluczowych etapów w procesie uzyskiwania pozwolenia na dopuszczenie do obrotu produktów leczniczych jest prawidłowe przygotowanie wniosku rejestracyjnego. Poprawnie wypełniony formularz odgrywa kluczową rolę w zapewnieniu zgodności z wymogami regulacyjnymi i umożliwia sprawną ocenę przez właściwe organy.
eAF – ustandaryzowany elektroniczny formularz wniosku dla procedur regulacyjnych w UE
Warto podkreślić, iż od stycznia 2016 r. stosowanie określonego rodzaju formularza – elektronicznego formularza wniosku (electronic Application Form, eAF) – jest obowiązkowe we wszystkich procedurach europejskich. Choć większość zgłoszeń wymaga wykorzystania eAF, w przypadku procedur narodowych niektóre organy krajowe nadal wymagają stosowania specyficznych, lokalnych formularzy rejestracyjnych.
Elektroniczny formularz rejestracyjny (eAF) to zunifikowany dokument cyfrowy, wykorzystywany we wszystkich typach procedur rejestracyjnych w Unii Europejskiej, takich jak:
- Procedura Centralna (centralised procedure, CP);
- Procedura zdecentralizowana (decentralised procedure, DCP);
- Procedura wzajemnego uznania (mutual recognition procedure, MRP);
- Procedura narodowa (national procedures, NP) – w wybranych państwach członkowskich.
Stosowanie eAF jest obowiązkowe zarówno dla produktów leczniczych stosowanych u ludzi, jak i weterynaryjnych produktów leczniczych. Formularz ten znajduje zastosowanie nie tylko przy składaniu pierwotnych wniosków o pozwolenie na dopuszczenie do obrotu, ale także w przypadku procedur zmianowych i rerejestracji.
eAF umożliwia spójne i uporządkowane przedstawienie kluczowych informacji o produkcie, takich jak:
- nazwa produktu, postać farmaceutyczna i moc,
- kategoria dostępności,
- miejsce wytwarzania,
- dane wnioskodawcy (podmiotu odpowiedzialnego).
Formularz zapewnia, że wnioski są składane w spójnym i zgodnym z wymogami formacie, co usprawnia ocenę przez organy kompetentne, takie jak Europejska Agencja Leków (European Medicines Agency, EMA) i krajowe agencje regulacyjne.
Korzystanie z eAF zwiększa efektywność procesu regulacyjnego, poprawia przejrzystość danych i minimalizuje ryzyko błędów we wnioskach dotyczących produktów leczniczych.
Formularz wniosku dla procedury narodowej w Polsce
Chociaż używanie eAF jest obligatoryjne dla większości procedur, w przypadku procedury narodowej w Polsce nadal pozostaje obowiązek składania wniosków w języku polskim. Warto wiedzieć, że dla tej procedury stosuje się dedykowane wzory wniosku narodowego, zarówno dla procedur o uzyskanie pozwolenia na dopuszczenie do obrotu, jak i zmian porejestracyjnych. Dlatego znajomość lokalnych wymagań regulacyjnych jest kluczowa dla prawidłowego przeprowadzenia procesu.

Na co zwrócić uwagę przygotowując wniosek
Podobnie jak w przypadku wielu innych działań regulacyjnych, również przy przygotowywania wniosku rejestracyjnego wymagane jest przestrzeganie aktualnych wytycznych i przepisów prawnych.
W szczególności warto pamiętać, że elektroniczny formularz wniosku (eAF) jest stale udoskonalany i regularnie aktualizowany. Jego aktualne wersje, wraz z przydatnymi instrukcjami dla użytkowników, dostępne są na stronie eSubmission.
Co istotne, formularz wniosku musi być w pełni zgodny z treścią dokumentacji rejestracyjnej – Modułami 1-5 Wspólnego Dokumentu Technicznego (ang. Common Technical Document, CTD). Błędy, niespójności lub braki w formularzu mogą prowadzić do uwag walidacyjnych, opóźnień w ocenie lub konieczności uzupełnień, co znacząco wydłuża czas rejestracji produktu. Dlatego prawidłowe i dokładne przygotowanie formularza eAF to jeden z kluczowych elementów w procesie rejestracyjnym.
Dlaczego my?
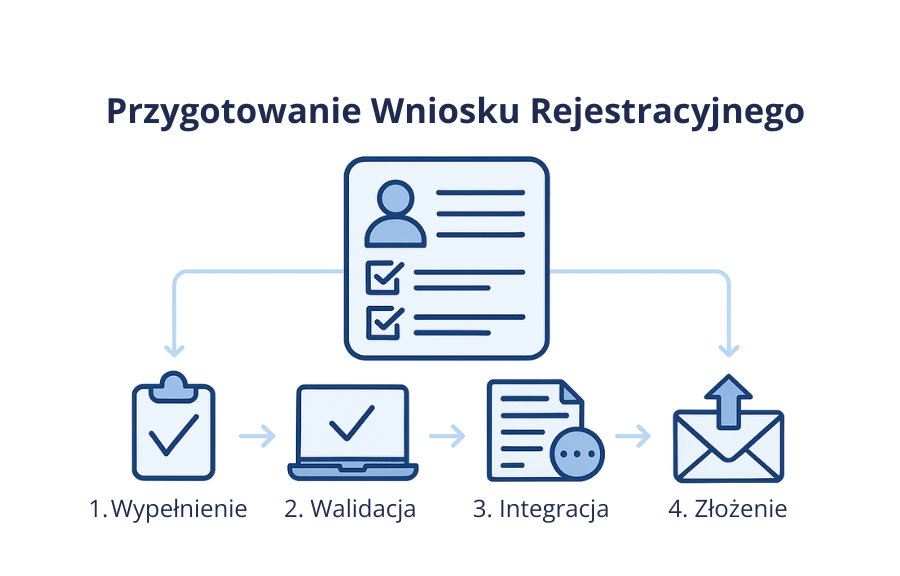
Profesjonalne wsparcie w przygotowaniu wniosku rejestracyjnego – zarówno eAF, jak i formularzy krajowych – może znacząco zwiększyć szanse na sprawne i pozytywne przeprowadzenie procedur dopuszczenia do obrotu lub procedur porejestracyjnych. Nasi eksperci ds. regulacyjnych zapewniają:
- dokładne i poprawne wypełnienie formularza,
- walidację przy użyciu oficjalnego narzędzia,
- prawidłowe sformatowanie i integrację formularza z dokumentacją eCTD,
- pełną zgodność z aktualnymi przepisami prawnymi i wytycznymi CMDh i EMA oraz oczekiwaniami krajowych organów regulacyjnych.
Korzyści współpracy
Ze wsparciem zespołu SciencePharma nadążanie za zmieniającym się otoczeniem regulacyjnym staje się znacznie prostsze. Oferujemy:
- kompleksowe wsparcie w przygotowaniu formularzy rejestracyjnych (zarówno eAF, jak i formularzy krajowych wymaganych w Polsce),
- składanie dokumentacji regulacyjnej,
- pełną obsługę procesów rejestracyjnych i porejestracyjnych – dostosowaną do indywidualnych potrzeb Podmiotu Odpowiedzialnego.
Śledzenie najnowszych wymagań regulacyjnych jest dużo łatwiejsze z doświadczonym i rzetelnym zespołem. W SciencePharma pomagamy uprościć Twoją drogę regulacyjną – tak, byś mógł skupić się na tym, co najważniejsze: wprowadzeniu produktu na rynek.

